筋のタンパク質
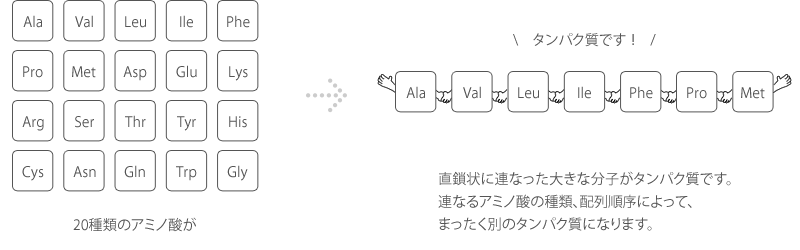
タンパク質とは、アミノ酸が直鎖状に縮合した、分子量1万から10万ほどの高分子です。
自然界にはたくさんの種類のアミノ酸が存在しますが、タンパク質はその内の20種類のアミノ酸で構成され、それぞれのタンパク質は皆固有の高次構造をもっています。
筋原線維を構成するタンパク質は、その機能ごとに3種類に分類することができます。
- 収縮タンパク質
- 筋収縮時に力を発揮する。
- 調節タンパク質
- 収縮という作用のオン・オフを切り替えるときに働く。
- 構造タンパク質
- 太いフェラメントと細いフェラメントを適切な位置に保持し、筋原線維に弾力性と伸長性を与え、筋原線維に筋形質膜と細肪外基質を結びつける働きがある。
生体の構造生成に使われているタンパク質のことを構造タンパク質といいます。この定義からすれば、ミオシンもアクチンも筋原線維の構造を形づくっているから、筋肉の構造タンパク質と考えられますが、収縮という特別な機能から見て収縮タンパクと呼ばれている。 1965年以後、トロポニンとトロポミオシンのカルシウム調節機能が発見されてから、調節タンパク質(レギュラトリー・プロテイン)の概念が確立し、江橋節郎と丸山工作が提案したこの用語が用いられるようになった。 調節タンパク質の用語は、細胞内の酵素の作用を調節するタンパク質に対しても使われるようになった。 筋原線維にはこれらのタンパク質以外にもいくつものタンパク質が存在しますが、機能が十分に解明されていないものも多い。
収縮タンパク質
contractile protein
収縮タンパク質は、筋収縮時に力を発揮するタンパク質の分類です。
収縮タンパク質には、ミオシンとアクチンの2種類があります。
アクチン上を移動する、モータータンパク質
ミオシン
myosin
太いフェラメントを構成するミオシンというタンパク質について説明します。
ミオシンはそれ自体が収縮するわけではありませんが、筋収縮に関与するタンパク質ということで、収縮タンパク質に分類されています。
ミオシンは3種の筋組織(骨格筋・心筋・平滑筋 詳しくは骨格筋以外の筋組織)のいずれにおいても駆動タンパク質(モータータンパク質)として機能しています。
駆動タンパク質は細胞内のさまざまな構造を動かすことによって、ATPの化学エネルギーを運動エネルギー…すなわち力の発揮に変換します。(ATPとは?)
分子モータータンパク質
直線および回転運度をするタンパク質。複合体を形成してタンパク質間相互作用により相対的な力を発生して、連続的運動をする。アクチンに作用するミオシン、チューブリンと作用するキネシン、ダイニンがあり、ATPの加水分解エネルギーを利用するATPaseである。
化学力学エネルギー変換によって運動するタンパク質を分子モーターと呼ぶ。以前には、運動機能は、筋肉のタンパク質であるミオシン分子に特有なものとであると考えられてきたが、1980年代以降みおしん以外にも構造が類似した運動機能を持つタンパク質(キネシン、ダイニン)がいくつか発見された。そしてそれらは細胞のいたるところに存在し、細胞内輸送や細胞分裂にひっすうであることがあきらかにされた。加えてミオシンでさえも筋肉に特有なものではなく、植物にも広く分布する多様性のある分子モータであることがわかった。
またミオシンのような運動をする線維状タンパク質はレールタンパク質と総称されてもいます。
筋原線維を構成するタンパク質の60%が、このミオシンです。

Szent-Györgyi(1893~1986)
ミオシンは1942年セント・ジェルジーによって単離されました。
なお、ミオシンは最初に発見されたモータータンパク質となります。
では、いよいよ筋の最小構成単位の1つであるミオシン分子の構造を見ていきましょう。
骨格筋のミオシン分子は約4000個のアミノ酸からなっています。
およそ200~400個で、1つの太いフィラメントを形成しています。(下図はイメージです)

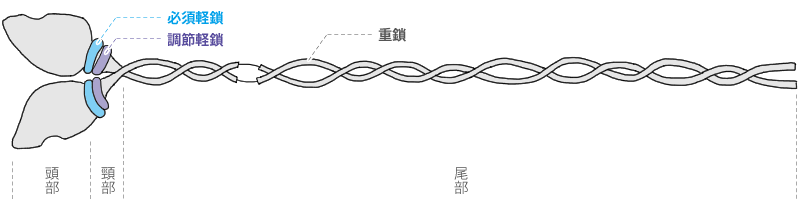
ミオシンは細長いタンパク質で(長さ約160nm)、一端が膨らむ2本の細長い繊維状のタンパク質(重鎖)が螺旋状により合わさっている棒状のタンパク質です。
これをもっと細かく見ていくと、それぞれ異なった機能を持つ、頭部、頸部、および尾部のドメインからなります。
(ドメインとは:タンパク質構造の一部で、ひとかたまりとして運動する領域のこと)
- 頭部の大きさ
- 長さ:約20nm、幅:約7nm。
- 尾部の大きさ
- 長さ:約140nm、幅:約2nm。
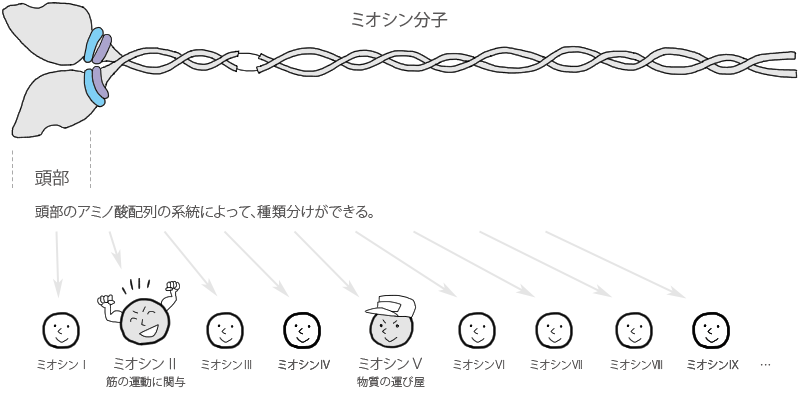
ミオシン分子には、ミオシン頭部のアミノ酸配列の系統発生的分類による種類があります。
例えば、筋肉の運動に関与しているのはミオシンⅡです。(そのため、その他のミオシンは「非筋ミオシン」と呼ばれます。)
つまりミオシンは、筋肉以外の多くの細胞に存在しているということで、例えば細胞分裂などにも重要な働きをしています。
よく聞かれるのは、細胞内で物質の運び屋(トランスポーター)として働いているミオシンⅤです。
このミオシンは、最近金沢大学で映像を撮影することに成功しています。(金沢大学 生物物理学研究室)
重鎖と軽鎖
ミオシンは、2本の細長い繊維状のタンパク質(重鎖)がより合わさっている、棒状のタンパク質です。
ミオシン重鎖は細く、一端が膨らむ杵状の分子(長さ150nm、幅2〜3nm、頭部の形は洋なし型に例えられます)であり、2本の重鎖の尾部が互いに螺旋状により合わさっています。
2本の重鎖がより合わさっている構造上、2つの頭部は外側に突き出している(突起・突出部)ように見えます。

ミオシンの尾部の中低部位には柔らかく折れ曲がりやすい部分があります。
トリプシン(膵臓の消化酵素)によりミオシンを処理すると、その部分のペプチド結合が分解されて、切断され、
頭部側のヘビーメロミオシン(heavy meromiyosin:分子量約22万・水溶性(HMN))と
尾部側のライトメロミオシン(light meromyosin:分子量約2万・この部分がミオシンに会合性と水不溶性をもたらしている (LMN))に分けられます。(※上図はイメージです。)
「メロ」とは部分を意味し、セントージェルジの命名です(1953年)。
ヘビーメロミオシンは、さらにキモトリプシン(タンパク質分解酵素)による処理で、頭部の付け根のところを境にして
サブフラグメント1(分子量10〜11万(HMN-S1))と、サブフラグメント2(分子量約6万(HMN-S2))に分けられます。
ミオシン頭部はこのサグフラグメント1(S1)に対応しています。
サブフラグメント1(S1)サブフラグメント(S2)はローウィの命名です。
様々な種類のミオシンが存在することは前述しましたが、すべてのミオシンがこの骨格筋のミオシンⅡのサブフラグメント1ドメインに似たドメインを持ち、それによって運動します。
なお、メロミオシンやサブフラグメントは、ペプチド結合を人為的に切断してできた断片で、天然に存在するサブユニットではありません。
したがってミオシンの構造は、
2本の重鎖(H鎖・heavy chain/分子量約22万)と
この重鎖に連なった2本ずつ2組(=4本)の軽鎖(L鎖・light chain/分子量2万前後)の、合計6本のホリペプチド鎖からなる複合体ということになります。
なお、4本の軽鎖は2本の調節軽鎖と2本の必須軽鎖からなっています。
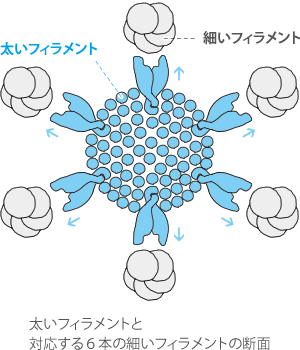
なお、ミオシン頭部は、ミオシンの軸から螺旋を描くように外方に規則的に突き出ているため、
太いフィラメントを構成する個々のミオシンの頭部は、
太いフェラメントを取り囲む6本の細いフェラメントのうちの1本に向かって伸びています。(※右図はイメージです。)
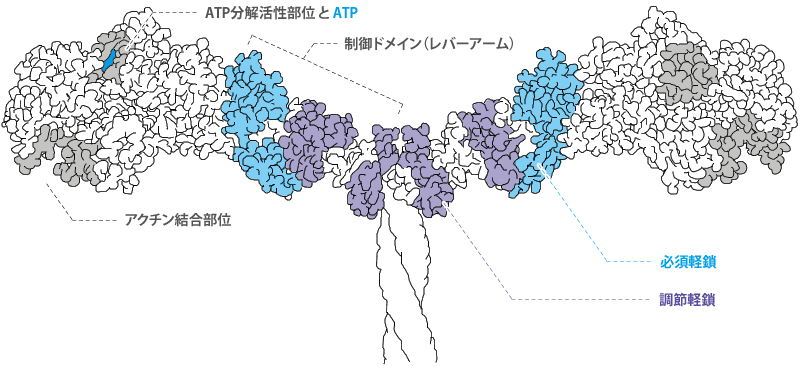
ミオシン頭部(サブフラグメント1)
ミオシン頭部は2つあり(双頭構造)、それぞれがATP分解活性(ATPase活性)部位、アクチン結合部位、軽鎖結合部位を持っています。(※下図はミオシン頭部のイメージです)
頭部のATPase活性部位とアクチン結合部位を含むドメインはモータードメイン、軽鎖結合部位を含むドメインは制御ドメイン(レバーアーム)と呼ばれています。
つまり、モータータンパク質である部分と、フェラメントを構成する部分は異なるものになります。
遺伝子工学を用いてミオシン分子の構造を作りかえ、ミオシンの頭の結晶をつくるような技術も飛躍的に進歩し、ミオシンの頭の構造の詳細はほぼ完璧に解き明かされました。
ミオシン分子が、燃料であるATPを結合する部分は、凹みのようになっていて口をあけたりしめたりするように動きます。
ミオシン尾部
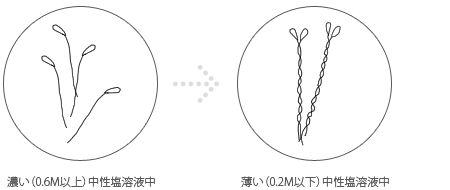
ミオシン分子は濃い(0.6M以上)中性塩溶液中ではバラバラ(モノマーといいます)になって、
溶解(分散)していますが、水で薄めると(0.2M以下)沈殿します。
この時、尾部は重合して会合体をつくり、長さ1~2μmのフェラメント構造をつくるのです。
(重合とは:ばらばらの分子が規則的な集合のしかたをして大きな塊をつくること)
尾部はミオシンの種類により多様性が見られ、自己会合したり輸送体と結合したりするなどの働きを持っています。
運動性には寄与しませんが、サブフラグメント1によって運ばれるものを決めています。
尾部はミオシンの種類ごとに異なっており、特定の積み荷と結合するようになっています。
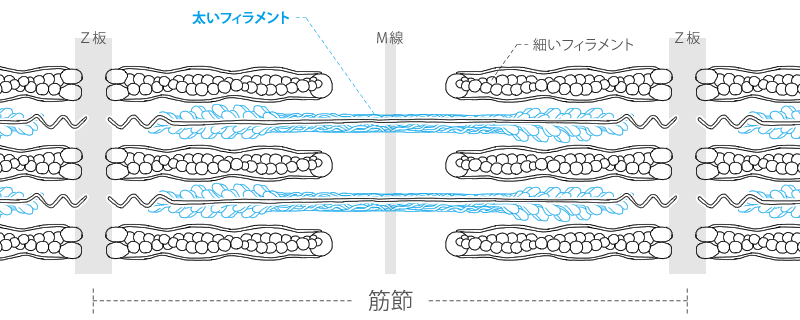
太いフェラメント
太いフィラメントは、このミオシン分子が約400本、規則正しく集合してできています。
ミオシン分子の尾部は平行に並び、アミノ酸残基の側鎖間の相互作用により側面同士で結合しています。そして会合して双極性のフィラメントになります。
いくつかの種類が存在するミオシンですが、収縮に関与するミオシンにのみ、この性質が見られます。
ミオシン分子の長さは、太いフィラメントの長さの一部に過ぎませんが、分子は互い違いに少しずつずれながら重合するので、
尾部は太いフィラメントのコアを形成し、球状の頭部はコアの側面から規則的な感覚で突き出すかたちになります。
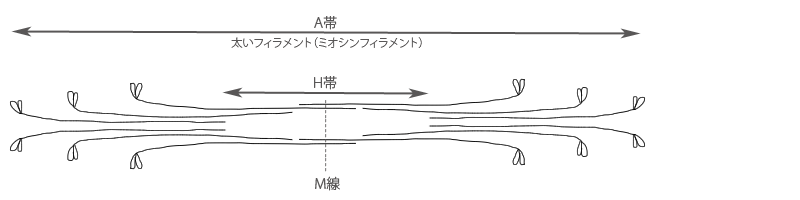
太いフィラメントの中央でミオシン分子の頭部はそれぞれフィラメントの両端に向いて配列されます。
したがって中央部はミオシン分子の突出がなく、顕微鏡で見るとH帯となって見えるのです。
体内に最も多く存在するタンパク質
アクチン
actin

Straub Ferenc Brunó(1914~1996)
1942年、ハンガリーの生化学者ストラウブ氏により、筋線維から発見されたタンパク質です。
アクチンは活性化タンパク質(ミオシンを活性かするタンパク質)という意味で、アクチンの名をセント=ジェルジが付けた。
アクチンはすべての真核生物(一般的な動植物)に存在する、分子量約42kDaのタンパク質で、最も多く存在する細胞内タンパク質です。
全細胞タンパク質の10%を占め、筋細胞では20%以上、非筋肉細胞でも1~5%を占めています。
あまねくすべての細胞に存在し、脳細胞、肝細胞などにも大量に存在しています。
筋細胞以外の細胞では、約半分は単量体として存在し、残りはフィラメントを形成して、動的に重合・脱重合を繰り返しています。
近年の遺伝子解析の研究によりアクチンは進化上、特によく構造が保存されていて、
酵母から人にいたるまで普遍的に存在していることが分かりました。
- アクチンの種類
- アクチンには6つのアイソフォーム…すなわち、αアクチン3種類(心筋、平滑筋、骨格筋)、βアクチン、γアクチン(筋肉以外、平滑筋)があり、それぞれ遺伝子が異なります。
(アイソフォームとは:基本的な機能に関連するアミノ酸残基は共通する一方、他の部分のアミノ酸配列が異なるタンパク質のこと)
アイソフォームそれぞれの間では90%以上の相動性を示します。 - アクチン分子の特性
- アクチン分子は重合と脱重合を繰り返し、(筋細胞中の細いフェラメントは構造上安定していますが、筋細胞以外では容易に分離・集合します)、ダイナミックな細胞活動を実現。
数多くの生命機能に密接に関わり、様々な細胞で重要な役割を担っています。
細胞骨格の形成や再編成、細胞内の物質輸送、細胞と外部の接着、筋細胞では上記の通りミオシン分子との相互作用により筋収縮を引き起こします。
また、神経細胞などではフィロポディア・ラメロポディアなどの形成により細胞の形を巧みに変形させることで神経活動に深く関与しています。
以上の通り、人を含む真核細胞にとって最も重要なタンパク質であるアクチンの変異は、さまざまな遺伝病の原因になることが知られています。(詳しくは細胞骨格)
G—アクチンとF−アクチン
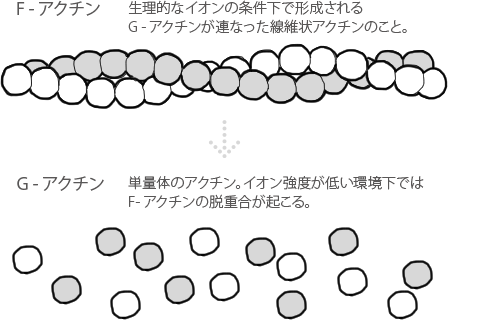
単量体のアクチンはほぼ球状をしていることから、
球状アクチン(G−アクチン:globular actin)と呼ばれています。
(375個のアミノ酸のからなる1本のポリペプチドで、分子量約5万)
G-アクチンは、生理的なイオンの条件下ではATP依存的に重合し、
2本のプロトフィラメント(直鎖状のアクチン重合体)が右巻きの螺旋状に絡まり、
線維状アクチン(F−アクチン:filamentous actin)を形成します。
イオン強度を下げると、線維状アクチンは球状アクチンに脱重合します。
直径10nmあまりと非常に細いタンパク質です。
Fアクチンは構造上も機能上も方向性を持っている
特異的にアクチンフィラメントに結合するミオシンの性質を利用して、アクチンフィラメントの方向性が分かります。
ミオシン頭部ドメインであるサブフラグメント1はアクチンサブユニットに対して特定の角度で結合します。
フィラメント内のアクチンサブユニットにS1が結合すると、フィラメントの周りを螺旋状に取り巻くように見えます。
このようになったアクチンフィラメントは矢じりが連結したように見え、この時矢じりのとがった方が、―端で、広がった方が+端です。
微小管や中間径フィラメントにはミオシンは結合しないので、
この矢じり修飾は薄い細胞切片の電子顕微鏡写真でアクチンフィラメントを他の細胞骨格線維と区別して同定する基準の一つとなります。
アクチンの分子構造
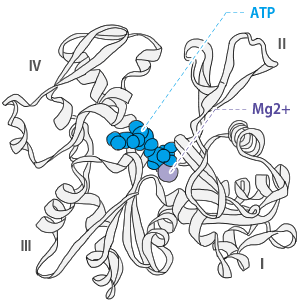
最近(1990年)、顕微鏡の発達によりアクチンの立体構造が決定されました。
アクチン分子は、真ん中の深い切れ込みでの大きく左右の2つのドメインに分かれます。
それがさらにⅠ~Ⅳのサブドメインに分けられます。
アクチン分子はこの切れ込みに1個のATPを抱え込んで強く結合しています。
それぞれのアクチン分子にはミオシン連結部位が存在し、そこにミオシン頭部が連結します。
細いフィラメント
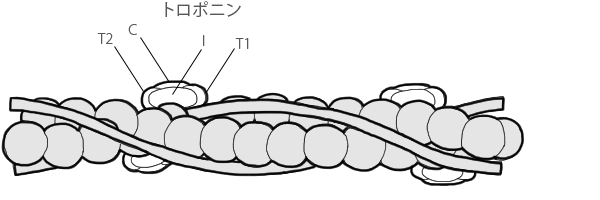
細いフェラメントはアクチン、トロポニン、トロポミオシンの3種のタンパク質(7:1:1のモル比)で構成されますが、
主体はアクチンなのでアクチンフェラメントとも呼ばれます。
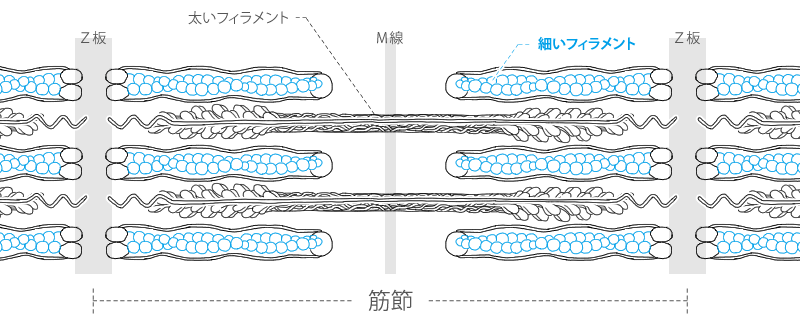
細いフィラメントはZ板に固定され、アクチン分子(Gアクチン)は静電的相互作用で数珠のように連なり、螺旋状に重合して細いフェラメントを形成しています。(二重螺旋状重合体)
細いフェラメントには細い紐状のトロポミオシンというタンパク質が巻き付いており、
また細いフェラメントの螺旋の1ピッチ(75nm)ことにトロポニンというタンパク質が存在しています。
いくつかの実験結果から、この細いフィラメントの曲がりやすさは、同じ太さの針金の数十分の一程度であることが分かりました。
さらに、ヘビメロミオシン(HMM)との共存化で、曲がり易さがより増大します。
また、細いフィラメントが0.8%程度の伸縮性をもつことともわかっており、非常に柔軟な構造であるということが分かっています。
調節タンパク質
regulatory protein
筋収縮のメカニズムに重要な役割を果たすタンパク分子があと二つあります。
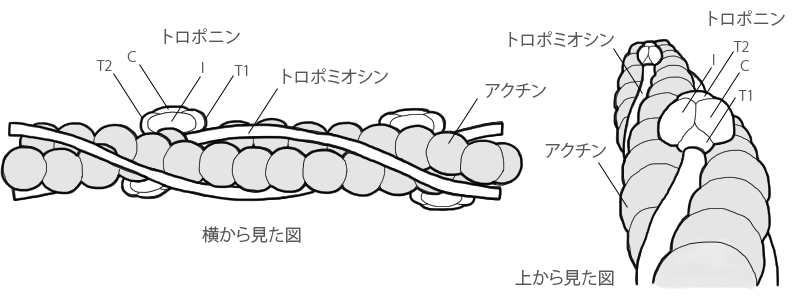
1つはトロポミオシン。その長い分子が細いフェラメントのアクチン分子に沿って存在しています。
もう1つは、トロポニン。トロポニン分子はトロポミオシン分子に規則正しい間隔で付着していて、Ca++の活動下で形状を変えることのできる複合体を形成しています。

トロポニン
troponin
トロポニンは筋収縮のカルシウム調節の中心をになうタンパク質です。
トロポニンは3個の球状のポリペプチドからなるタンパク質(T,C,Iの三成分からなる複合体 構成比1:1:1)で、
2本のアクチンの間に、トロポミオシンにそって、25〜30nmの間隔をおいて規則正しく並んでいます。
トロポニンは3種類の、構造や機能も異なったタンパク質1分子ずつの複合体で、しかもカルシウムのシグナルによって作動する、見事な生体調節機構と言うことができます。
トロポニンCは、筋肉タンパク質を構成する細いフィラメントに結合しているカルシウム結合タンパク質(分子量18000)で、一本の細いフィラメント上に24個が存在しています。
トロポニンCは、心筋でも、骨格筋でも、アミノ酸配列に差はありません。
しかしトロポニンTとトロポニンIについては、心筋と骨格筋ではアミノ酸配列が異なります。
従って、心筋由来のトロポニンT、Iと骨格筋由来のトロポニンT、Iはそれぞれ区別して測定することが出来、
心筋トロポニンT、I、特に心筋トロポニンT(TnT)は心筋障害マーカーとして用いられてます。
各トロポニンの役割
- トロポニンT(T1、T2)
- トロポミオシン結合。トロポニンTをキモトリプシン(タンパク質分解酵素)で分解すると、T1、T2と2断片に切断されます。
T1とT2は、アクチンフィラメント上の位置が多少ずれており、T1は主としてトロポミオシンと結合し、T2の方はトロポニンCと結合しています。
トロポニンTは西洋ナシの形をしているものと考えられます。
トロポニンTはアクチン上のトロポミオシンの一定部位と結合しています。
そしてトロポニンCとIを1分子ずつ結合させて、トロポニンをアクチンフィラメント上に規則正しく配置させているのです。
江橋節郎氏により命名。 - トロポニンI
- アクトミオシン相互作用阻害。
ベリー氏により命名。 - トロポニンC
- カルシウム結合。トロポニンCには、強い結合部位2箇所と、弱い部位2箇所があり、強い部位にカルシウムが結合するとトロポニンCの構造変化が起こります。
この変化はトロポニンCの構造が固くなるもので、分子中のアルファらせんというコイル構造の部分が多くなる。
ハートシェーン氏により命名。

江橋 節郎(1922~2006)
トロポニンは江橋節郎によって発見、命名されました。
トロポミオシン
tropomyosin
トロポミオシンは長さ40nm、幅1.5〜2nmで、2本の長い糸状のタンパク質(αとβの2つのサブユニット)がよじれ合ってできています。
分子量65000~70000、アクチン結合タンパク質で、7つのアクチンサブユニットと結合しています。
つまりトロポニン一分子はトロポミオシン一分子を通じてアクチン七分子を支配しているのです。
細いフィラメントのねじれた二重螺旋の溝に沿って1本ずつ結合し、その構造を安定化しています。
トロポミオシン分子の尾部には、他のトロポミオシン分子が結合し、連続した鎖状になり、アクチンフィラメント側面の2つの溝に結合します。
2本のαへリックス(αヘリックスとは:ポリペプチド鎖がとりうる安定な螺旋構造の一つ)からなるコイルドコイル(二重螺旋)の構造をしており、
これらの鎖は疎水結合でお互いが繋がっています。
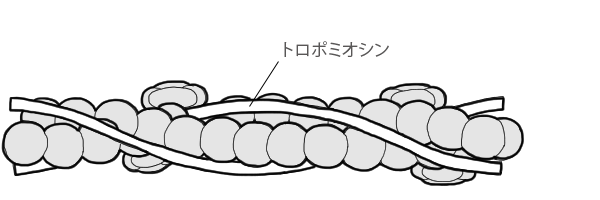
種類ごとの違いが大きいタンパク質で、骨格筋を始めとして平滑筋や無脊椎動物の筋肉にも広く存在し、会合体をつくりやすく、容易に結晶化します。
例えば、心臓のトロポミオシンはαトロポミオシンからできています。
イギリスのK.ベイリーが発見し(1946)、江橋節郎が生理的機能を解明しました。

トロポニン・トロポミオシンのアレルギー
トロポニンは甲殻類(エビやかに)アレルギーを引き起こす原因といわれています。
成人日本人の約60~70人、つまり約1.5%の人がえび・かにアレルギーをもっているといわれ、
アナフィラキシーショックのような重篤な即時型過敏反応を引き起こすことが多いとされています。その上、熱にも強い。
トロポミオシンをアレルギーの原因とする患者さんは、様々な生物のトロポミオシンにも反応します。
ダニやゴキブリなどにも反応するので、喘息やアトピー性皮膚炎を併発している場合もあります。
構造タンパク質
structural protein
筋には10種類あまりの構造タンパク質が存在します。
これらは筋原線維の位置と形状の維持、弾力性、そして伸展性に関わっています。
主な構造タンパク質はタイチン、ネブリン、α−アクチニン、ミオメシン、そしてジストロフィンです。
他にはcapZ、トロポモジュリン、デスミンなどがあります。
タイチン(チチン:弾性タンパク質コネクチン)
titin

タイチンは骨格筋中でアクチン、ミオシンに次いで3番目に量が多いタンパク質です。
26,926個のアミノ酸から成っており(普通のタンパク質はアミノ酸が平均300個)、
これまで知られている中で最も大きなタンパク質です。
また、アルファベット表記で18万9819文字ともっとも長いIUPA名をもつ物質としても知られています。
(IUPA名:化学者の国際学術機関である「国際純正・応用化学連合」が定める化合物の体系名)
「タイチン」という名称は、ギリシャ神話の巨人ティーターン(titan:タイタン)からとられたもの。
1分子の質量が300万ドルトンもあるので、タイチンは普通のサイズのタンパク質の50倍に相当します。
個々のタイチン分子の長さは筋節の半分に及び、Z板からM線に至ります。すなわち弛緩時の長さは1~1,2μmです。
タイチンはZ板とM線の両方に密着し、それによって太いフェラメントの位置を安定させています。
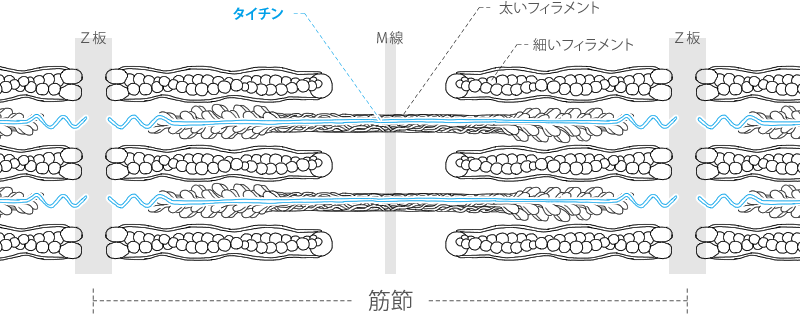
タイチン分子のZ板から太いフェラメントの始まりに至る範囲は、弾力に富んでいます。
通常の長さの4倍に伸びて、損傷無しに元にもどることができるので、タイチンは筋原線維の弾力性と伸展性の要因となっています(ばねのように作用する)。
筋節が引き伸ばされすぎるのを防ぎ、A帯の中心位置を保持するのもタイチンだと思われます。
名取りファイバー、つまり細胞膜をはがした筋線維を引っ張るとゴムひものような弾性を示します。筋線維の弾性は結合組織つまり筋膜の性質と見られていました。1954年 名取礼二が筋細胞内弾性構造を予言したが、誰も確かめることができずにいました。 1975年 丸山工作は光学顕微鏡下では何もみえないが何かZ線間の連結があることに気づき、ようやく、弾性タンパク質の集合体と思われるものを見つけます(筋の残渣から調整した)。1977年フィラメントの幅は2nmほどで、アクチンフィラメントよりもずっと細いこのタンパク質を繋ぐという意味でコネクチンと名づけます。 1979年アメリカのワンが分子量によって分別するゲル濾過法でわけたタイチンと名づけました。 1980年 アミノ酸組成などからコネクチンと同じものであることがわかりました。先取り件を巡って、激しい闘争をしましたが、命名のうまさ、宣伝力から今はタイチンという名前の方がよく使われています。くやしいので、私たち日本人はコネクチンとよびましょう。これも良い名前です!!!! 1989年 丸山工作はコネクチンを純粋な形で取り出すことに成功、これだけ長い時間がかかったのは、巨大なタンパク質であったが故にタンパク質分解酵素によって分解されやすい。それで単離が技術的に非常に難しかった。

丸山 工作(1930~2003)
発見者は丸山 工作(1975)
タイチンは「コネクチン」とも呼ばれます。
なぜ、名前がいくつもあるのでしょうか?
当初、発見者の丸山博士はこのタンパク質を「コネクチン」と命名しましたが(1977)、
その後、アメリカの研究者ワンが「巨大だから」という理由で「タイチン」と命名すると、タイチンの方が世界でメジャーとなりました。
この結果は、現在の特許制度や宣伝力、命名のうまさ、人種の問題とも合わせて考えさせられます。
ネブリン
nebulin
分子量77万、骨格筋では筋原線維タンパク質の約2~3%を占めています。
こちらも500~900kDaの巨大なフィラメント状のタンパク質です。
ネブリンは細く、弾力性がないタンパク質で、細いフェラメントを全長にわたって包んでいます。
細いフェラメントをZ板に固定するのを助け、細いフェラメントが出来上がる時、その長さを調節しています。
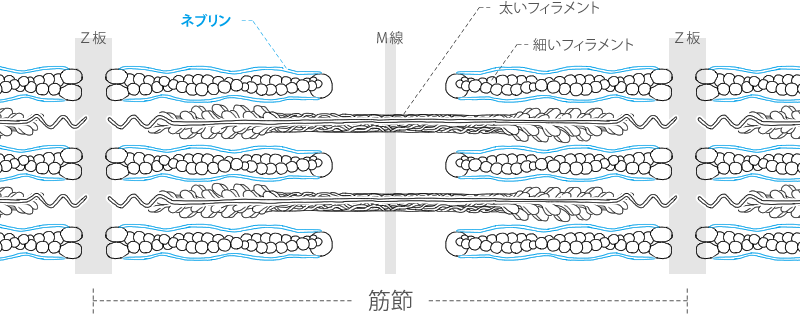
骨格筋の細いフィラメントは、1μmと揃った長さをして整然と並んでいます。
元々アクチン分子は重合・脱重合を繰り返すので長さが一定ではありませんが、骨格筋線維の細いフィラメントの長さが一定である理由として、
生体内ではいくつかのアクチン結合タンパク質、およびネブリンが存在するためではないかと考えられています。
ネブリン1分子は、細いフィラメント全長にわたって伸展した状態で存在しており、
そのN末端(アミノ酸末端)は細いフィラメントの先端に位置し、C末端(カルボキシ基末端)はZ板の中に入り込んでいます。
1本の細いフィラメント当たり、ネブリン2分子が存在すると考えられています。
Z線からアクチン線維が形成される時はネブリンに沿って伸長します。心筋にはネブリンが存在せず、代わりに長さが役0.15μmのネブレットが存在している。
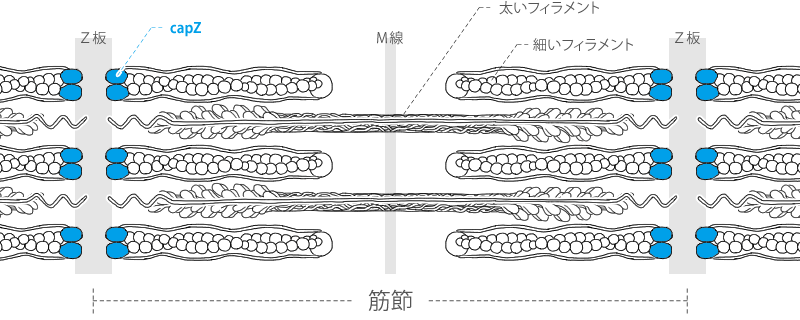
capZ(βアクチニン)
capZ
細いフィラメント+端のキャッピングタンパク質。
細胞内で細いフィラメント(アクチン)の重合・脱重合過程を制御しているキーとなるタンパク質の一つである、キャッピング・プロテイン(CapZ)です。
2つのサブユニット(αとβ)が2回対照の構造を構成(異種二量体タンパク質)し、2本の動きやすい腕を利用して細いフィラメントへの結合を行なっています。
細胞内でのアクチンの重合・脱重合の過程は、アクチン結合タンパク質とよばれる種々のタンパク質によって制御されていますが、
中でも細いフィラメントの末端をキャップして、アクチン分子の重合やフィラメントからの分子の脱重合を防いでいるキャッピング・プロテイン(CP)というタンパク質は、
この過程の制御の鍵となるタンパク質の一つであるといわれています。
さらに、キャッピング・プロテインは、細いフィラメントの末端を細胞内の他のタンパク質や構造体に繋ぎ止める役割をしていると考えられています。
筋肉中ではZ線という筋肉細胞内の仕切りに細いフィラメントを繋ぎ止めており、筋肉形成を行なう為に必須の存在です。
キャッピング・プロテインはさまざまな生物種、細胞内に幅広く存在しており、非常によく保存されていることからも
生体内での細いフィラメントの働きに重要なタンパク質であることがわかります。
解明された構造から、CapZ分子は細長い形状をしており、
また、αとβの2つのサブユニットは、アミノ酸配列では全く類似性がみられないにもかかわらず、立体構造としては非常によく似ていることが分かっています。
更にその2つのサブユニットが2回回転対照の関係で強固に組み合わさり、1つのCapZ分子を構成しています。
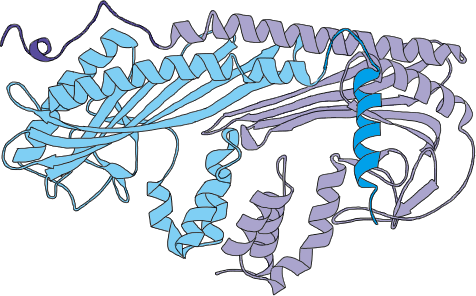
CapZのアクチン結合部位は、分子内に2カ所、
αサブユニット(右図薄紫部分)とβサブユニット(同水色薄水色部分)から
それぞれ1本ずつ2本の腕のように分子(それぞれ濃い部分)から突き出て存在しています。
この腕は分子の中で動きやすい構造をしていること、
また、アクチンへの結合には腕の疎水性側表面を利用していると考えられています。
細いフィラメントは、アクチン分子が螺旋状に配列している構造をしているため、
2回対照の構造をもつCapZとでは構造の対称性が異なります。
しかし、CapZは腕が動きやすいこと、
さらに実際の両腕はアミノ酸配列が異なるため細かくみると違いがあることを利用して、
この対称性の違いを巧みに補正し細いフィラメントに結合していると考えられます。
また、動きやすい腕と強固に構築された本体をもつCapZの構造は、
細いフィラメントの細胞内でのダイナミックな性質を制御するのに有利であると考えられています。
一般的にいって、タンパク質を構成する単位はサブユニットと呼ばれる。これらのサブユニットは、非共有結合と呼ばれるごく弱い化学結合で互いに結合しており、アミノ酸を結合するペプチド結合のような強い共有結合とは区別される。
βアクチニン→キャップZ もともとは丸山工作が、1977年アクチンフィラメントの性質を調節し制御するタンパク質第1号として発見。しかし付着する場所をアクチンフィラメントの矢尻端と発表したため、87年になってカセラが反矢尻端につくと報告し、Z線にあるからというのでギャップZと名づけました。先に見つけたのに、残念ながら反矢尻端の方につくのが正しく今はギャップZと呼ばれてます。残念!矢尻端につくのは1980年にアメリカで発見されたトロポモジュリンです。
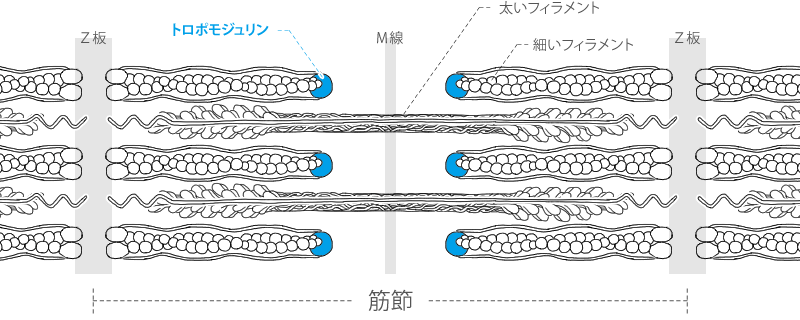
トロポモジュリン
tropomodulin
トロポモジュリンは細いフィラメントの-端に結合し、フィラメントの長さや安定性を制御するタンパク質です。
筋肉においては、細いフィラメントの長さを一定に保つ仕組みを担っていると考えられています。
一方でアクチンと、他方でトロポミオシンと結合し、細いフィラメントをキャッピングしています。
αアクチニン(アクチニン、交差結合タンパク質、架橋タンパク質、結束タンパク質)
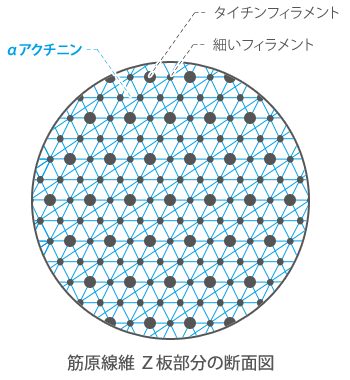
α—actinin
分子量は~100kDa。1965年に発見された、代表的なアクチン結合タンパク質です。
江橋節郎・文子夫妻と丸山工作により、
骨格筋の粗精製アクチンよりトロポニンの生成過程で超沈殿を促進する活性因子として分離された、
最初のアクチン結合タンパク質です。
当時のアミノ酸組性分析ではアクチンと類似しているデータが得られた為に、「アクチニン」と命名されました。
密生組織であるZ板で、細いフェラメントはαアクチニンに結合し、
これによって隣接する筋節の細いフェラメントとジグザグ状にお互いに連なります。
基本的にはアクチン線維と共存しており、この結合はネブリンで補強されています。
また、αアクチニンはシグナル伝達に関与する足場タンパク質としても機能し、
シナプスにおいて重要な働きをしているとも考えられています。
2つのアクチニン アクチニンの名は、誤った実験結果からつけられたものです。江橋節郎が活性トロポミオシンを調整していたとき、副産物として2種類の未知のタンパク質が得られた。アクチンに作用するこれら2種類のタンパク質因子の組成を調べてみると、両者ともアクチンとよく似ていた。そこでアクチンと似て非なるタンパク質でしかもアクチンに作用するもののことをアクチニンとなづけることにした。クレアチンの代謝物にクレアチニンという物質のあることに習ったわけである。 量的に多いゲルか因子をα少ない分散因子の方をβと呼ぶことにした。 αアクチニンはその作用がドラマチックだったので、アメリカのモンメールやゴルが取り上げ、たくさんの論文が1967年以降発表されて、名前が定着していきました。(丸山工作 筋肉の謎 岩波新書 より) アクチン線維同士を架橋している。Z線に存在
デスミン
desmin
デスミンはZ線のタンパク質です。
デスミンは筋節間(Z帯)に存在し、過剰な伸展を抑制するように働くタンパク質です。
デスミンは、筋細胞の強度や組織化を担っている。デスミンフィラメントはZディスクに巻き付き、細胞膜に架橋されている。縦方向のデスミンフィラメントは同じ筋原線維内の隣り合うZディスクを結びつけている。更に隣り合うZディスクのまわりのデスミンフィラメント同士が連結される結果、筋細胞内で筋原線維が架橋されて束になる。デスミンフィラメントからなる格子は、ミオシンの太いフィラメントとの相互作用を介して、サルコメアにも付着している。デスミンフィラメントはサルコメアの外に存在しているので、収縮力の発生に積極的には参加しておらず、むしろ筋肉内の一体性を維持するのに重要な構造的役割をはたしている。デスミンを欠くトランスジェニックマウスではこの構造が失われるので、Zディスクの配列が乱れる。また、このマウスではミトコンドリアの位置や形態にも異常があることから、中間径フィラメントは細胞の小器官の組織化にも寄与していると考えられている。
ミオメシン
myomesin
M線には、隣接する太い筋フェラメントを横に結合するように3本の繊細な線維がみられます。
中央がミオメシン、両側がC−タンパク質ででき、タイチンと結合し近傍の太いフェラメントを互いに連結させ太いフェラメントの位置を安定させています。
M―タンパク質
M線に局在する
C―タンパク質
ミオシン結合タンパク質C
Z線のタンパク質
筋原線維の縦断面では、Z線はジグザク構造にみえ、横断面では格子状になっている。 Z線は高い密度を示し、かなりのタンパク質が存在することは明らかであった。
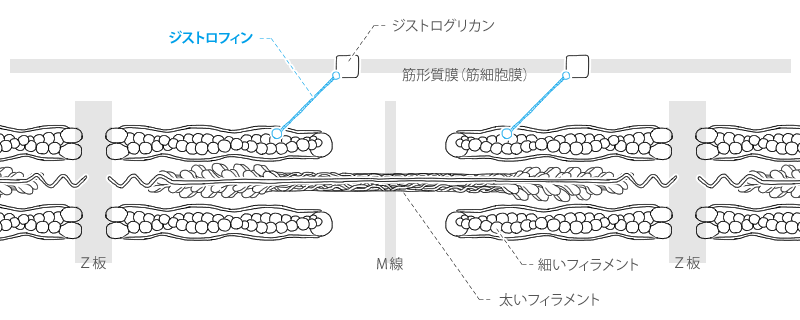
ジストロフィン
dystrophin
ジストロフィンは、細いフェラメントを筋形質膜の内在性膜タンパク質に連結させる働きがあります。
詳しく言うと、
・ジストロフィンのN末端にはアクチン結合ドメイン
・中央にはスペクトリンに似た配列の繰り返し
・そしてC末端には膜貫通タンパク質ジストログリカン複合体と結合するドメイン
があります。
この複合体は細胞外マトリックス、ラミニンと結合しています。
ジストロフィンとその関連するタンパク質は筋形質膜を補強し、筋節によってつくられる張力を腱に伝える役割を果たすと考えられています。
0.002%を占めるタンパク質です。
ジストロフィンの欠損は一部の筋肉の病気(ミオパチー)の原因となり、
ジストロフィンの欠損によって引き起こされるミオパチーは、総称して「筋ジストロフィ―」と呼ばれます。(筋ジストロフィーとは)
Copyright (C) karada-university.com All Rights Reserved.